

En France, le cancer de la prostate représente la deuxième cause de mortalité par cancer chez l’homme (11 % des décès par cancer) derrière le cancer bronchique et devant le cancer du côlon et du rectum. Au delà de 70 ans, il constitue le premier motif de décès par cancer.
Le Dépistage de ce cancer est basé sur le dosage du PSA et la réalisation du toucher rectal. Néanmoins, l’utilisation du dosage du PSA conduit, dans près de 30% des cas, à découvrir des cancers, de petite tailles, peu agressifs, qui ne nécessiteraient aucun traitement. Depuis plusieurs années, les recommandations nationales et internationales (Association Française d’Urologie, Association Européenne et Américaine d’ Urologie…) proposent une alternative aux traitements radicaux du cancer : la Surveillance Active.
De nombreux cancers de la prostate progressent lentement et ne nécessitent donc pas de traitement au moment du diagnostic. La validité de cette approche a été confirmée par plusieurs séries prospectives, certaines ayant maintenant un long suivi (tableau 1) . Une surveillance active, grâce à des contrôles réguliers, devient une option de thérapeutique possible pour les hommes dont le cancer est de petite taille, de faible agressivité. Le but de la surveillance active est alors de différer un traitement immédiat du cancer, de suivre attentivement l’évolution naturelle de la maladie pour ne la traiter qu’en cas de progression.
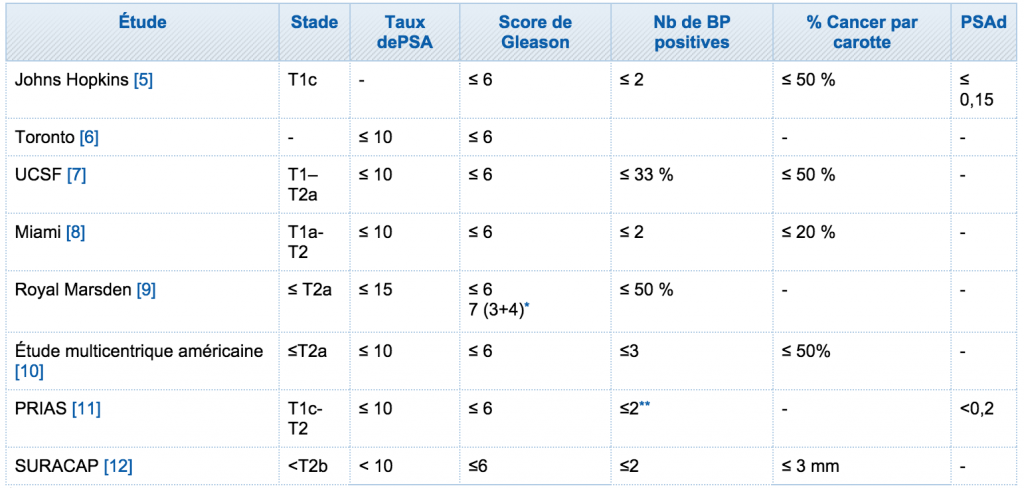
Tableau 1 : étude surveillance active – recommandations AFU 2013
La surveillance active est basée sur l’estimation de l’agressivité et du volume du cancer (taille de foyers cancéreux sur chaque biopsie, nombre de foyers cancéreux, score de Gleason), le PSA, la densité du PSA (rapport PSA/volume prostatique).
Recommandations de l’association Française d’Urologie :
Score de PRIAS Prostate Cancer Research International Active Surveillance
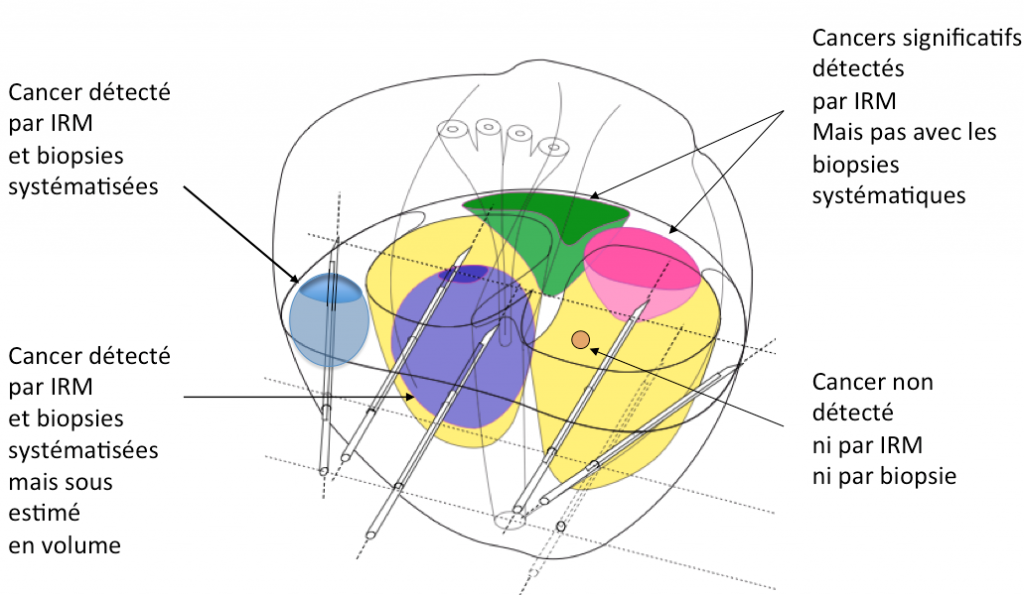
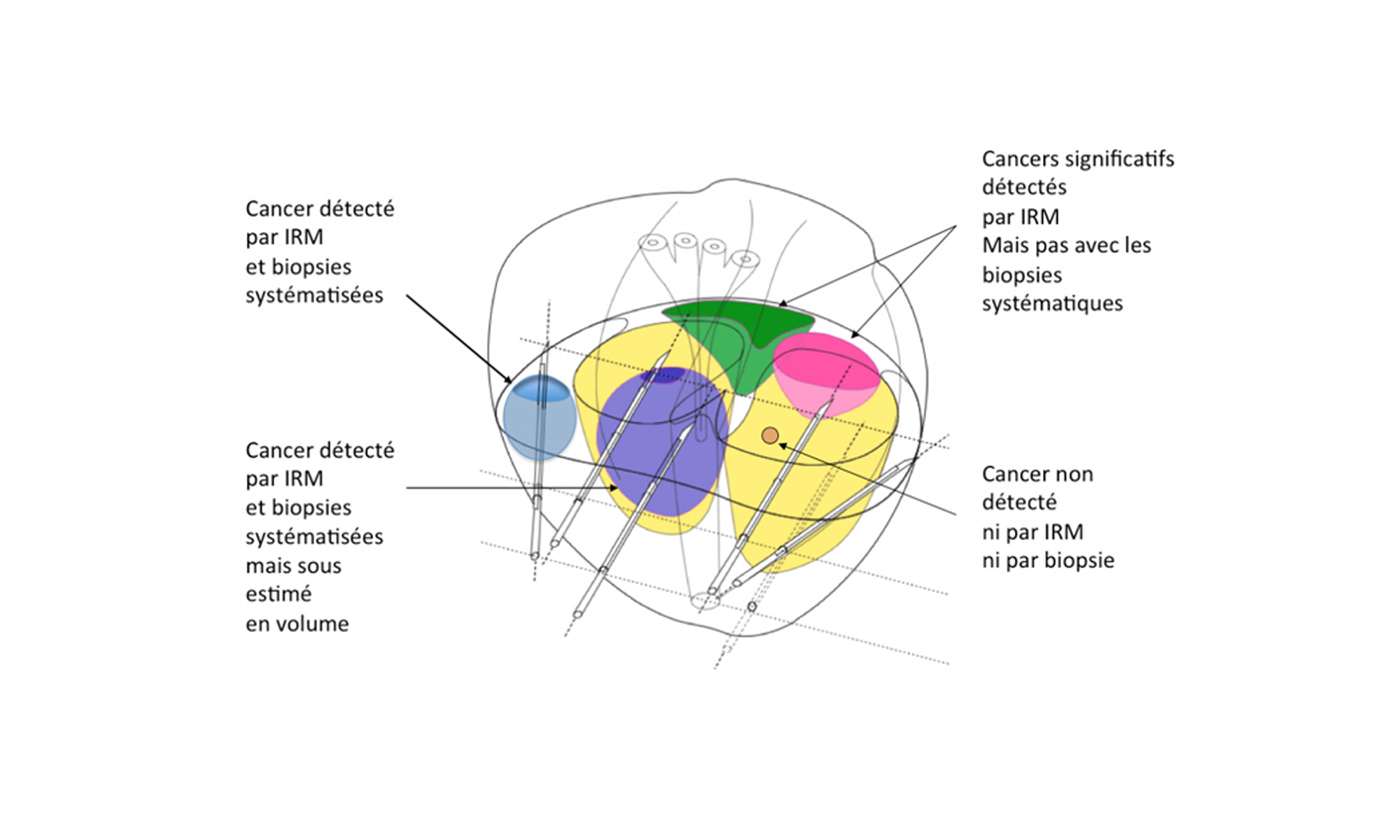
Modélisation des résultats des biopsies prostatiques systématisées en fonction de la taille et de la position du cancer
L’irm prostatique multiparamétrique est actuellement l’examen le plus performant pour la détection et la localisation du cancer de la prostate. L’utilisation combinée des différentes séquences (T2, avec injection de gadolinium, de diffusion et cartographie ADC) permet d’obtenir un score de suspicion (échelle LIKERT ou PIRADS) corrélé au risque de cancer.
Elle permet de :
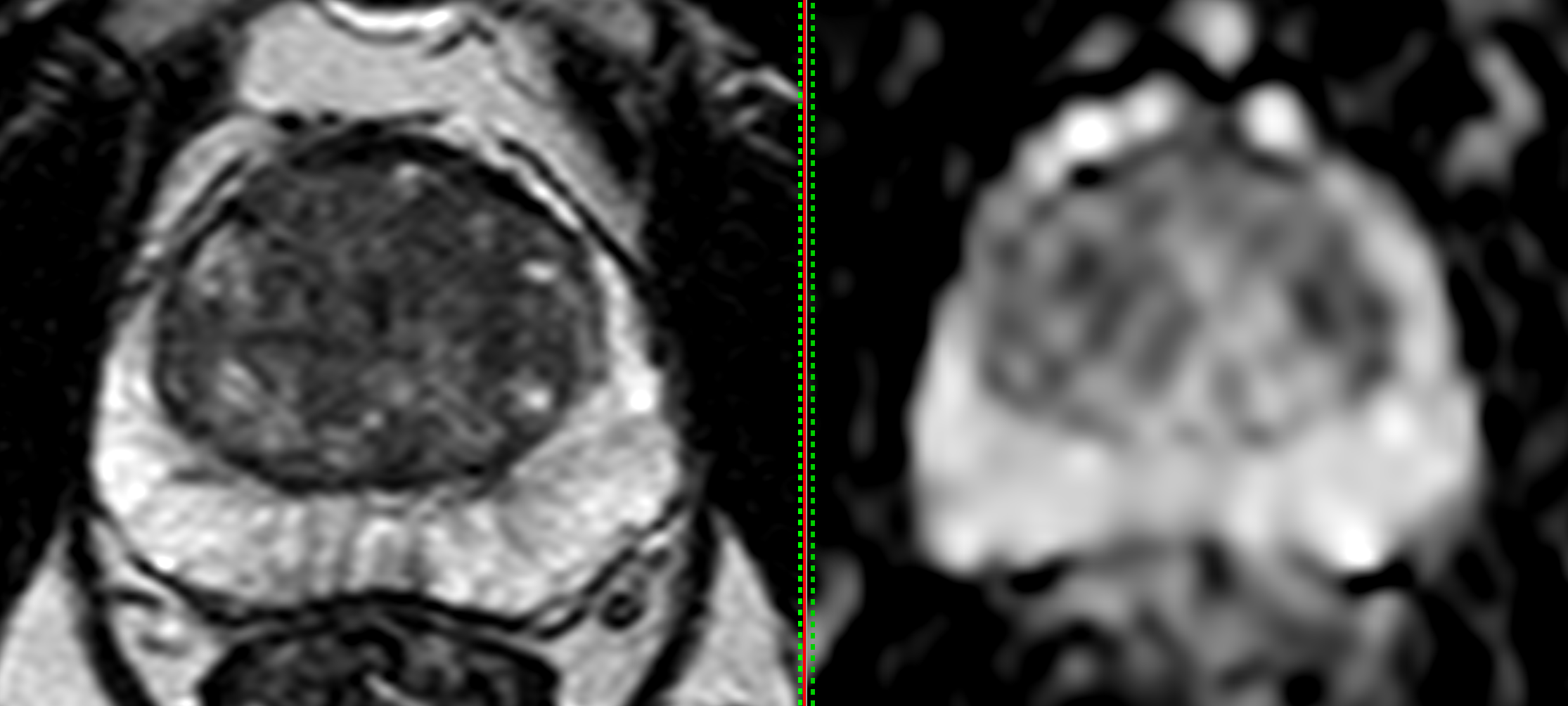
IRM prostatique normale
Une IRM normale, classée PIRADS 1 ou 2 permet d’éliminer la présence d’un cancer significatif dans près de 97% des cas.
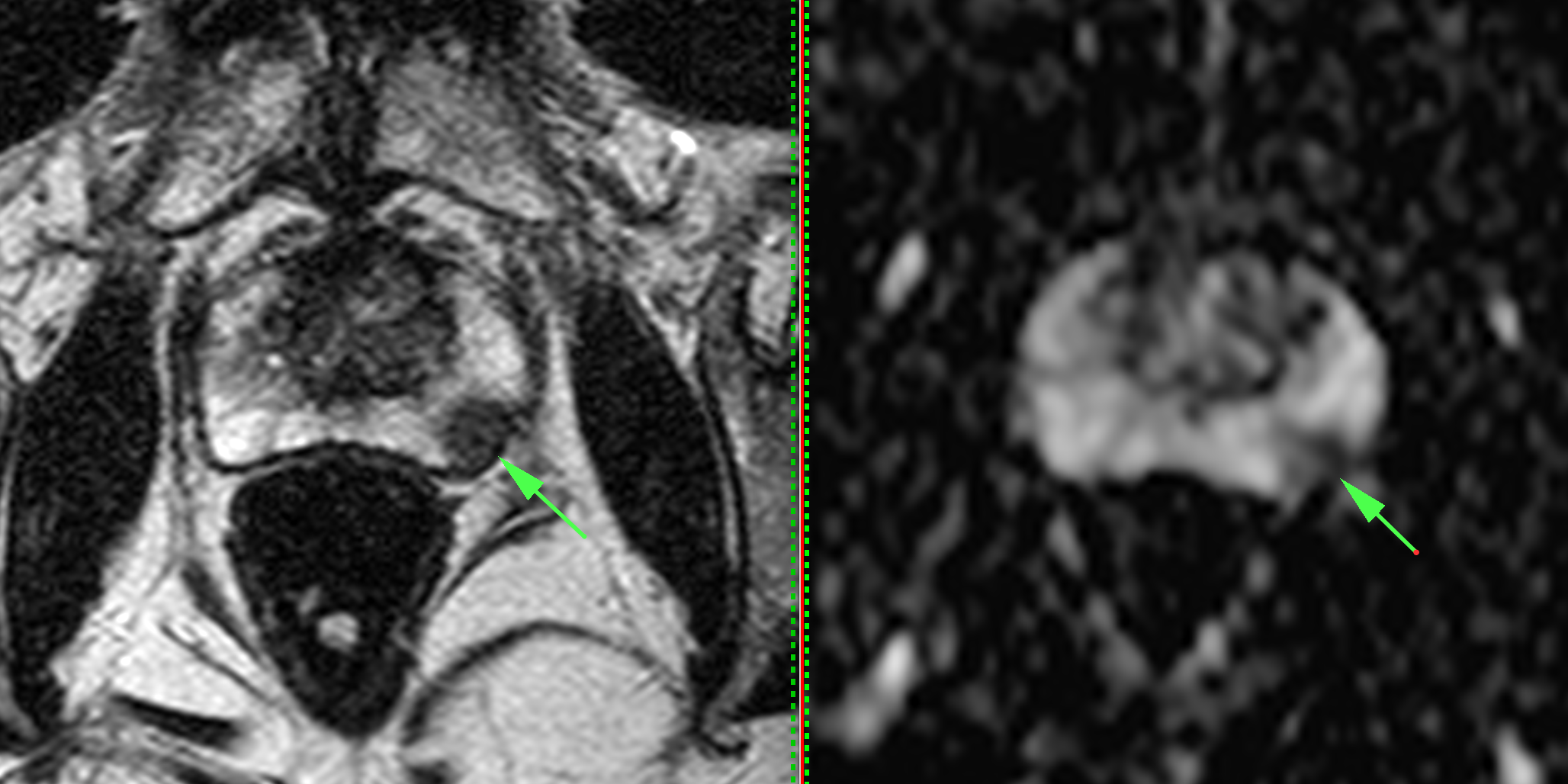
Cancer localisé au niveau du lobe gauche de 8 mm score Pi-rads 4
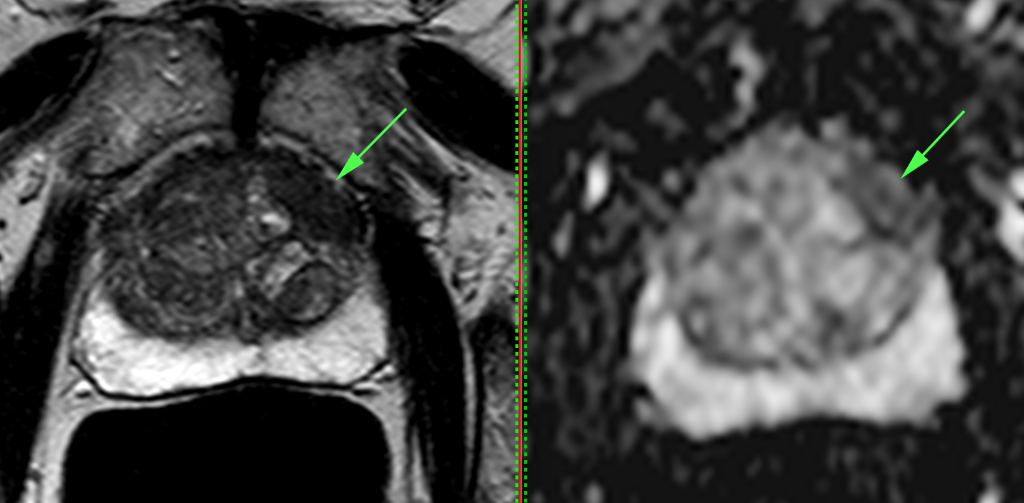
Patient ayant un cancer de la prostate sur une biopsie de 2 mm avec volumineuse lésion au niveau de la partie antérieure gauche de 22 mm, score Pi-rads 5
Plus le score de Gleason est élevé (4 ou 5) , plus la diffusion est sensible.
Actuellement, différents systèmes permettent la superpostion des images de l’IRM avec celle de l’échographie per-opératoire afin de repérer avec une précision millimétrique les différentes zones suspectes visibles en IRM. Ces techniques de fusion d’images améliorent la précision des biopsies, et permettent une meilleure analyse du volume et de l’agressivité du cancer (correspondance dans plus de 80% des cas entre le score de Gleason des biopsies et la pièce opératoire contre 30 % en cas de biopsies systématisées standards). Cela diminue le risque de sous évaluation du cancer.
De plus, la position de l’ensemble de ces biopsies sera enregistrée , et pourra être utilisée lors des prochains contrôles (second look) . Cela améliore les possibilités de contrôle pour les patients éligibles à la surveillance active chez qui des biopsies de contrôle seront réalisées durant les 1eres années.
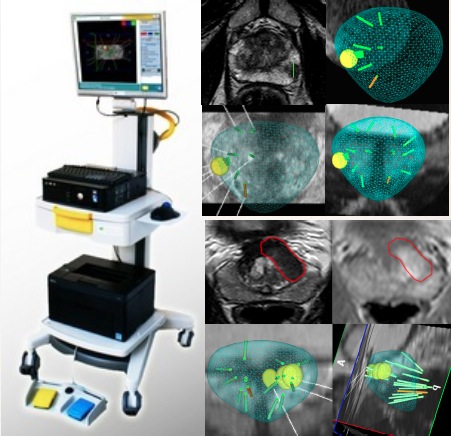
Biopsies de la prostate guidage IRM par fusion 3D (KOELIS) pour un cancer périphérique et antérieur
La surveillance active est une option thérapeutique essentielle dans la prise en charge du cancer de la prostate et L’IRM de la prostate est vouée à occuper une place de plus en plus grande dans l’algorithme diagnostique et thérapeutique du cancer de la prostate. Couplée à un système de fusion d’images, l’IRM oriente la réalisation des biopsies permettant ainsi une meilleure caractérisation du cancer détecté.